علوم للصف الثاني الاعدادي
.الدرس الاول
محاولات تصنيف العنا صر
لماذا حاول العلماء تصنيف العناصر؟
1) حتي يسهل دراستها ديمتري مندليف
2) لايجاد علاقة بين العناصر و خواصها الكيميائية و الفيزيائية
وكان اول جدول دورى حقيقي لتصنيف العناصر هو الجدول الدورى لمندليف
الجدول الدورى لمندليف
1) و ضعة العالم الروسي ديمتري مندليف سنة 1871م
2) كتب اسماء العناصر على بطاقات منفردة و كتب مع جميع عنصر و زنة الذري و خواصه
3) بعدها رتب العناصر تصاعديا حسب اعدادها الذرية من يسار الجدول الى يمينة فصفوف افقية (عرفت فيما بعد بالدورات)
4) و رتب العناصر المتشابهة فاعمدة راسية (عرفت فيما بعد بالمجموعات)
5) و جد ان خواص العناصر تتكرر بصفة دورية مع بداية جميع دوره
6) اوضح مندليف فكتابة (مبادئ الكيمياء)ان عدد العناصر المعروفة حتي ذلك الوقت 63 عنصر
ملحوظة بعض العناصر لها عدة صور تتفق فالعدد الذري و تختلف فالوزن الذري تسمي ب ( النظائر )
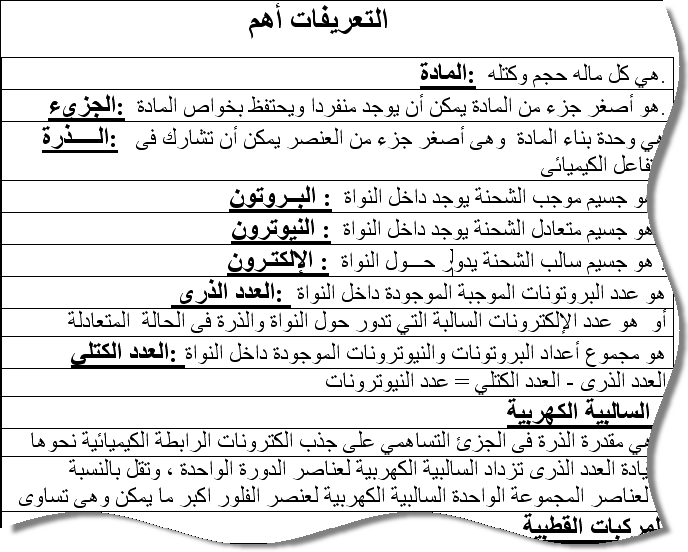
النظائر : هي صور مختلفة لعنصر واحد تتفق فالعدد الذري و تختلف فالوزن الذري
مميزات الجدول الدورى لمندليف
1- تنبا بامكانية اكتشاف عناصر حديثة و حدد قيم اوزانها الذرية و خواصها
1.
صحح الاوزان الذرية المقدرة خطا لبعض العناصر
2- ترك خانات فارغة لعناصر توقع اكتشافها
عيوب الجدول الدورى لمندليف
1.
اخل بالترتيب التصاعدى لبعض العناصر لوضعها فالمجموعات التي تناسب خواصها .
2.
وضع اكثر من عنصر فخانة واحد كالنيكل و الكوبلت .
الجدول الدورى لموزلى
1- اكتشف العلم النيوزلندى رزرفورد عام 1913 ان نواة الذرة تحتوي على بروتونات .
2- فنفس العام درس موزلي الخواص الفيزيائية و الكيميائية للعناصر و وجد انها ترتبط بالعدد الذري و ليس الوزن الذري .
3- لذا اعاد موزلي ترتيب العناصر تصاعديا حسب اعدادها الذرية بحيث يزيد العدد الذري لكل عنصر عن العنصر يسبقة بمقدار واحد صحيح و اضاف اليها الغازات الذي الخاملة فالمجموعة الصفرية .
4- قسم عناصر جميع دورة الى مجموعتين فرعيتين هماA و B حيث و جد فروقا بين خواصها .
5- خصص مكانا اسفل الجدول لمجموعتى اللانثانيدات و الاكتنيدات .
الجدول الدورى الحديث
اكتشاف العالم الدنماركي ( بور ) لمستويات الطاقة و عددها سبعة فاثقل الذرات المعروفة حتي الان .
تم اكتشاف مستويات الطاقة الفرعية و التي تعتبر المستويات الحقيقية للطاقة .
لذا تم اعادة تصنيف العناصر تبعا ل:
1- التدرج التصاعدى (الزيادة) فالعدد الذري .
2- كيفية ملء مستويات الطاقة الفرعية بالالكترونات .
معلومة اضافية
* جميع مستوي طاقة رئيسى يتكون من عدد من مستويات الطاقة الفرعية تساوي رقمه
فمثلا مستوي الطاقة الرئيسى ( Nالرابع ) يتكون من اربع مستويات فرعية هي ( S و P و D و f ) و مستوي الطاقة ( k الاول ) يتكون من مستوي فرعي واحد هو( S )
اكمل مستوي الطاقة L يتكون من …… مستويات فرعية هي ………
مستوي الطاقة M يتكون من …… مستويات فرعية هي ………
وصف الجدول الدورى الحديث ( الطويل )
• يتكون الجدول الدورى من 7 دورات افقية 18 مجموعة راسيه
• تنقسم مجموعات الجدول الدورى الى :
1.
مجموعات يسار الجدول و هي
2.
مجموعات يمين الجدول و هي
3.
تقع المجموعة الصفرية تقع يمين الجدول و تضم الغازات الخاملة.
– ابتداء من الدورة الرابعة يفصل بين مجموعات يسار و يمين الجدول مجموعة من العناصر تسمي بالعناصر الانتقالية و تشغل المجموعات يلاحظ ان المجموعة الثامنة تشمل ثلاثة اعمدة .
– رقم الدورة يدل على عدد مستويات الطاقة فالذرة.
– رقم المجموعة يدل على عدد الالكترونات فمستوي الطاقة الخارجى للذرة.
ملحوظة تضم المجموعة الصفرية (0) الغازات الخاملة
مجموعات و سط الجدول و تبدا اعتبارا من الدورة الرابعة
وتفصل بين مجموعات يمين و يسار الجدول و تسمي العناصر الانتقالية
وعددها 10 مجموعات و هي متميزة بالحرف B و مرتبة كما يلي:
3B ,
4B,5B,6B,7B,8,1B,2B
ملاحظات
المجموعة 8 تتكون من ثلاث مجموعات ( اعمدة )
عدد العناصر التي تم اكتشافها حتي الان 116 عنصر منها فالطبيعة 92 و الباقى يحضر فالصناعة و هي عناصر مشعة تتحلل انويتها فاقل من ثانيه
تحديد موقع العنصر (عناصر المجموعاتA) فالجدول الدوري
اولا : نكتب التوزيع الالكترونى للعنصر ثانيا : عدد مستويات الطاقة يدل على رقم الدورة
ثالثا : عدد الالكترونات فمستوي الطاقة الخارجى يدل على رقم المجموعة
امثلة لتحديد موقع بعض العناصر بالجدول الدورى الحديث :
الماغنسيوم 12Mg توزيعة الالكتروني2,8,2
لذا يقع فالدورة الثالثة المجموعة 2A
الكلور 17Cl توزيعة الالكترونى 2,8,7
لذا يقع فالدورة الثالثة المجموعة 7A
الكربون 6C توزيعة الالكتروني2,4
لذا يقع فالدورة الاخرى المجموعة4A
الكالسيوم 20Ca توزيعة الالكترونى 2,8,8,2
لذا يقع فالدورة الرابعة المجموعة2A
خصائص الجدول الدورى الحديث .
1.
ترتب العناصر تصاعديا حسب اعدادها الذرية.
2.
تتدرج خواص عناصر المجموعة الواحدة ( من اعلي الى اسفل ) مع زيادة العدد الذري.
مثال:
عناصر المجموعة A1 تسمي عناصر الاقلاء،
وتزداد الصفة الفلزية من اعلي الى اسفل .
3.
عناصر المجموعة الواحدة لها نفس التكافؤ.
4.
تتدرج خاص عناصر الدورة الواحدة.
( بزيادة العدد الذرى ) من يسار الجدول ( عناصر فلزية ) الى يمين الجدول ( عناصر لا فلزية ) .
مثال:
حدد موقع ى الجدول الدوري.
1) عدد مستويات الطاقة فالذره 4 اذن العنصر يقع فالدورة الرابعة
2) عدد الكترونات المستوي الخارجى للذره 2 اذن العنصر يقع فالمجموعة الثانية
حدد بنفسك موقع العناصر الموضحة:
الارجون 18Ar البورون 5B البوتاسيوم 19K
السليصبح 14Si الفلور 9F
اسئلة على الدرس الاول
س1:اكمل الكلمات التالية
1- البروتونات جسيمات شحنتها ……………… و النيوترونات جسيمات شحنتها……………..
2- اكتشف العالم ……………..
ان النواة تحتوي على بروتونات
3- اكتشف مستويات الطاقة العالم ……………………
4- يعتبر جدول ………………..
هو اول جدول دورى حقيقي لتصنيف العناصر
5- رتب مندليف العناصر …………… حسب ……………..
6- صحح مندليف ……………..
المقدرة خطا لبعض العناصر
7- اخل مندليف بالترتيب التصاعدى لبعض العناصر لوضعها فاماكن تناسب ……….
8- و جد موزلي ان خواص العناصر ترتبط …………..
وليس ………………
9- عدد مستويات الطاقة فاثقل الذرات المعروفة حتي الان هو……………
10- خصص موزلي مكان اسفل جدولة لمجموعتى عناصر ……….و…………..
11- تم تصنيف العناصر فالجدول الدورى الحديث على اساس العدد الذرى و كيفية ملء مستويات الطاقة بالالكترونات
12- يتكون الجدول الدورى من 7 دورة افقية و 18 مجموعة راسية
13- توجد المجموعة الصفرية اقصي يمين الجدول الدوري
14- توجد المجموعة الاقلاء اقصي يسار الجدول الدوري
15- العدد الذري للعنصر عدد صحيح يزداد فالدورة الواحدة من عنصر للعنصر الذي يلية بمقدار واحد صحيح
16- تتميز مجموعات و سط الجدول بالرمز B و تسمي العناصر الانتقالية و تبدا اعتبارا من الدورة الرابعة
17- يدل رقم الدورة على عدد مستويات الطاقة فالذرة و يدل رقم المجموعة على عدد الكترونات مستوى الطاقة الخارجي
18- عنصر عددة الذري 13 يقع فالدورة الثالثة و المجموعة 3A و هو من عناصر الفئة P
19- عنصر يقع فالدورة الاخرى و المجموعة السادسة فان عددة الذري يساوي 8
س2 : اختر الاجابة الصحيحة
1- يعتبر ………….اول جدول حقيقي لتصنيف العناصر
( الجدول الدورى الحديث – جدول مندليف – جدول موزلي )
2- جسيمات فالذرة ممكن اهمال شحنتها و لا ممكن اهمال كتلتها
(البروتونات – النيوترونات – الالكترونات)
3- رتبت العناصر فجدول مندليف تصاعديا حسب …..
( اعدادها الذرية – اوزانها الذرية – نشاطها الكيميائى )
4- رتب موزلي العناصر حسب
( اعدادها الذرية – اوزانها الذرية – نشاطها الكيميائي)
5- خصص موزلي مكان اسفل الجدول لعناصر الفئة
( s ,
p ,
d ,
f )
6- اكتشف العالم …………….
مستويات الطاقة ( بور – رذرفورد – موزلي )
7- عنصر عددة الذري ( 20 ) يقع ف……………………….
( الدورة الثالثة – المجموعة الرابعة – الدورة الثانية- المجموعة الثانية)
8- توجد الغازات النبيلة فالمجموعة…………………….
( الاولي – المجموعة الثامنة – المجموعة الصفرية )
9- توجد مجموعات عناصر اللانثانيدات الاكتنيدات ………….
الجدول الدوري
( يمين – يسار- و سط – اسفل )
10 – الفوسفور عددة الذري 15 يقع ف…………….
( الدورة الخامسة و المجموعة الثالثة – الدورة الثالثة و المجموعة الخامسة – الدورة الثالثة و المجموعة الثالثة )
11 – يبدا ظهور العناصر الانتقالية اعتبارا من الدورة
(الاولي – الثانية- الثالثة – الرابعة)
س3 : ضع علامة صح او علامة خطا
1 – العدد الذري هو مجموع اعداد البروتونات و النيوترونات التي توجد داخل النواة () 2- رتب مندليف العناصر تصاعديا حسب اعدادها الذرية ( )
3- صحح مندليف الاوزان الذرية المقدرة خطا لبعض العناصر ( )
3- من متميزات جدول مندليف انه وضع اكثر من عنصر فخانة واحد ( )
5- من عيوب جدول مندليف انه ترك خانات فارغة ( )
6- اكتشف العالم رزرفورد ان النواة تحتوي على بروتونات ( )
7- اكتشف موزلي ان دورية خواص العناصر ترتبط بالعدد الذري و ليس الوزن الذري ( )
س4 : علل لما ياتي :
1- الذرة متعادلة كهربيا ؟
لان عدد البروتونات الموجبة الموجودة فالنواة تساوى عدد الالكترونات السالبة التي تدور حول النواة.
2- تتركز كتلة الذرة فنواتها ؟
لان كتلة الالكترونات مهملة لان كتلتها ضئيلة اذا ما قورنت بكتلة النواة
3- النواة موجة الشحنة؟
لوجود فيها بروتونات موجبة الشحنة و نيترونات متعادلة الشحنة
4- محاولة العلماء تصنيف العناصر؟
• لسهولة دراستها.
• ايجاد علاقة بين العناصر و خواصها الفيزيائية و الكيميائية.
5- وجود متميزات و عيوب لجدول مندليف؟
• فمن المميزات
ترك خانات فارغة فجدولة لتنباة بامكانية اكتشاف عناصر جديدة.
تنبا بقيم الاوزان الذرية للعناصر التي لم تكتشف بعد
صحح قيم الاوزان الذرية المقدةر لبعض العناصر
• و من العيوب
اضطر الى الااثناء بالترتيب التصاعدى للعناصر حسب الوزن الذرى لوضعها فالمجموعات التي تتناسب مع خواصها
اضطر الى التعامل مع نظائر العنصر الواحد على انها عناصر مختلفة لاختلاف اوزانها الذرية
6- اعاد موزلي ترتيب العناصر حسب اعدادها الذرية ؟
لانة و جد ان دورية خواص العناصر ترتبط باعدادها الذرية و ليس باوزانها الذرية كما كان يعتقد مندليف
7- قسم موزلي عناصر جميع دورة الى مجموعتين فرعيتين هما (A ,
B )
لانة و جد فروق فخواص جميع منهما.
8- اعادة ترتيب العناصر فالجدول الدورى الحديث ؟
بسبب اكتشاف مستويات الطاقة فصنفت العناصر على حسب كيفية ملء مستويات الطاقة بالالكترونات و حسب اعدادها الذرية.
9- معرفة العدد الذري للعنصر تحدد موقعة فالجدول الدورى ؟
لانة عند معرفة العدد الذرى ممكن معرفة عدد مستويات الطاقة فنحدد رقم الدورة لانة يساوية عدد مستويات الطاقة ،
ومعرفة عدد الكترونات مستوى الطاقة الخارجى فيساوى رقم المجموعة.
10 – تسمي عناصر المجموعة الصفرية بالغازات الخاملة ؟
لانها عبارة عن غازات نبيلة و خاملة لا تتفاعل فالظروف العادية
س5 :اكتب المفهوم العلمي :
1- جسيمات فالذرة تهمل كتلتها و لا تهمل شحنتها الالكترونات
2- جسيمات فالذرة تهمل شحنتها و لا تهمل كتلتها النيترونات
3- جسيمات فالذرة لا ممكن اهمال كتلتها او شحنتها البروتونات
4- ترتيب العناصر تصاعديا حسب اعدادها الذرية الجدول الدورى لموزلي
5- اول جدول حقيقي لتصنيف العناصر الجدول الدورى لمندليف
6- ترتيب العناصر حسب التدرج فاعدادها الذرية و كيفية ملء مستويات الطاقة الفرعية بالالكترونات الجدول الدورى الحديث
7- المستويات الحقيقية للطاقة فالذرة مستويات طاقة رئيسية
8- مجموع اعداد الالكترونات التي تدور فمستويات الطاقة حول النواة العدد الذري
س6: ما العدد الذري لكل من العناصر التالية و ما الفئة التي ينتمي اليها و نوعة ؟
1- عنصر يقع فالدورة الثالثة و المجموعة الاولي ا
2- عنصر يقع فالدورة الاخرى و المجموعة الثالثة ا
3- عنصر يقع فالدورة الرابعة و المجموعة الاخرى ا
4- عنصر يقع فالدورة الاخرى و المجموعة السادسة ا
5- عنصر يقع فالدورة الاولي المجموعة الاولى
6- عنصر يقع فالدورة الثالثة و المجموعة الرابعة ا
7- عنصر فلزي يقع فالدورة الثالثة و تكافؤة ثلاثي
8- عنصر لا فلزي يقع فالدورة الاخرى و تكافؤة ثنائي
9- عنصر لا فلزي احادي التكافؤ يقع بالدورة الثالثة
10- عنصر فلزي ثنائى التكافؤ يقع فالدورة الثالثة
س7 : ما المقصود بكل من:
الذرة الجزيء البروتونات النيوترونات الالكترونات العدد الذرى
الجدول الدورى لمندليف الجدول الدورى لموزلي الجدول الدورى الحديث
عناصر الفئة S عناصر الفئة d عناصر الفئة f
س8 : صل من العمود (ا) ما يناسبة فالعمود (ب) :
ب ا
• صنف العناصر تبعا لاوزانها الذرية
• اكتشف مستويات الطاقة الفرعية
• اكتشف مستويات الطاقة الرئيسية
• صنف العناصر تبعا لاعدادها الذرية
• اكتشف البروتونات
• وضع الجدول الدورى الطويل
• موزلى
• مندليف
• رذرفورد
• بور
- اسئله على الجدول الدوري الحديث رسومات الصف الثاني الاعدادي
- صور اسئله علوم الصف التاني
- علل ترك مندليف خانات فارغة بلجدول الدوري
- علوم الصف الثاني الاعدادي الدرس الاول الخواص الكيمياية للعانصر لاالا فلزية
- ما هى الذرة المتعادلة كهربيا في مادة العلوم للصف الثاني الاعدادي
- منهج علوم الصف الثانى الاعدادى الترم التانى